化学の基本法則の一覧。質量保存の法則、倍数比例の法則、気体反応の法則の 3 つは特に重要。
| 法則 | 発見人物 | 内容 |
|---|---|---|
| 質量保存の法則 | ラボアジェ | 化学反応の前後で物質全体の質量は変わらない |
| 定比例の法則 | プルースト | 化合物の元素質量比は常に一定 |
| 倍数比例の法則 | ドルトン | 元素 A、B からなる化合物が 2 種類以上あり、それぞれについて一定質量の A と化合している B の質量は簡単な整数比になる |
| 気体反応の法則 | ゲーリュサック | 気体同士の反応で、反応気体と生成気体の体積は(同温同圧において)簡単な整数比になる |
| アボガドロの法則 | アボガドロ | 同温同圧同体積において気体の分子数は一定 |
質量保存の法則
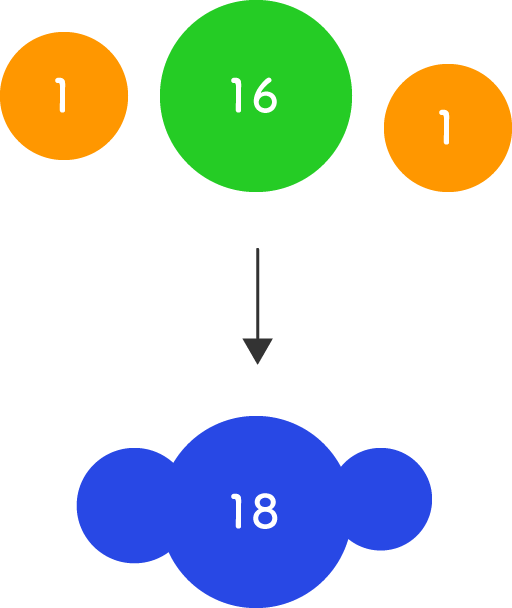
水素と酸素は反応して水になる。水素 2g と酸素 16g が反応すると 18g の水ができる。この 18 は 2 と 16 を足した値であり、反応前後で質量が変わらないことがわかる。
もし 17g になったら、1g がどこかの世界に消えてしまったことになる。逆に 19g になったら、1g がどこかよその世界からやってきたことになる。
定比例の法則
水を構成している水素と酸素の質量比は上で求めたように 2:16、すなわち 1:8 である。水がどのような状態になっても、どのような質量であっても、この比は変わらない。
定比例の法則があるからこそ物質を一つの化学式として表現できる。
倍数比例の法則
窒素と酸素が反応すると一酸化窒素と二酸化窒素の両方ができる。一酸化窒素と二酸化窒素を集めて質量を計測するとこのようになる。
| 説明 | 一酸化窒素 | 二酸化窒素 |
|---|---|---|
| 総質量 | 30mg | 46mg |
| 窒素質量 | 14mg | 14mg |
| 酸素質量 | 16mg | 32mg |
窒素質量を 14mg にした時の一酸化窒素と二酸化窒素の酸素質量はそれぞれ 16mg と 32mg であり、比にすると 1:2 である。簡単な整数比になった。
窒素の質量を同じにして、酸素の質量を比べる。これが倍数比例の法則のポイントである。
気体反応の法則
一酸化炭素と酸素が反応すると二酸化炭素ができる。一酸化炭素と酸素をそれぞれ 44.8ml と 22.4ml 用意すると、過不足なく反応して 44.8ml の二酸化炭素ができる。
| 一酸化炭素 | 酸素 | 二酸化炭素 |
|---|---|---|
| 44.8ml | 22.4ml | 44.8ml |
この 3 つの体積は 2:1:2 となり、簡単な整数比になることがわかる。これを気体反応の法則という。
アボガドロの法則
0 度、1atm(1.01×105Pa)において 22.4L の気体には 6.02×1023 個の分子が含まれているという法則。
水素も酸素もアルゴンもすべて、同じ個数が集まると同じ体積になる。








