酵素とは、タンパク質でできた触媒です。
消化酵素(アミラーゼやペプシン)はタンパク質でできた触媒で、基本的な役割は化学反応の促進であり、反応前後で自身は変化しません。
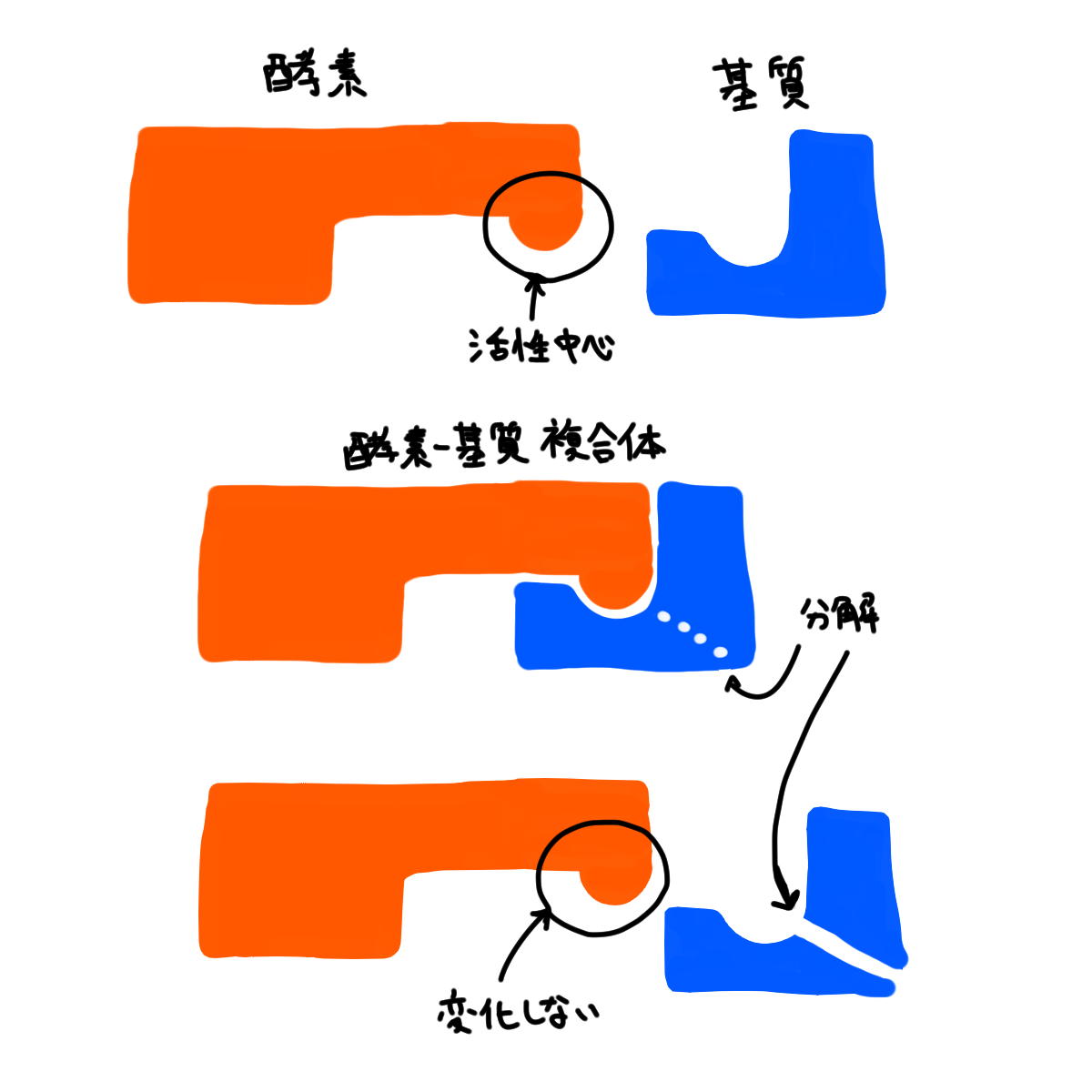
酵素が関わる相手(アミラーゼであればデンプン、ペプシンであればタンパク質)を基質とよびます。後述するように酵素は基質と結合して酵素基質複合体となり、基質は酵素基質複合体を経て分解されます。
消化酵素まとめ
| 消化酵素 | 関わる反応 | 生体内の存在場所 |
|---|---|---|
| アミラーゼ | デンプン → マルトース | だ液(口) |
| ペプシン | タンパク質 → ポリペプチド | 胃 |
| トリプシン | ポリペプチド → 短鎖ポリペプチド | すい臓 |
| ペプチダーゼ | ポリペプチド → アミノ酸 | すい臓 |
| リパーゼ | 脂肪 → 脂肪酸とグリセリン | すい臓 |
三大栄養素は炭水化物(デンプン)、タンパク質、脂質の三つ。デンプンはアミラーゼとマルターゼ、タンパク質はペプシン、トリプシン、ペプチダーゼ、脂質はリパーゼによって分解されます。
アミラーゼ・ペプシン
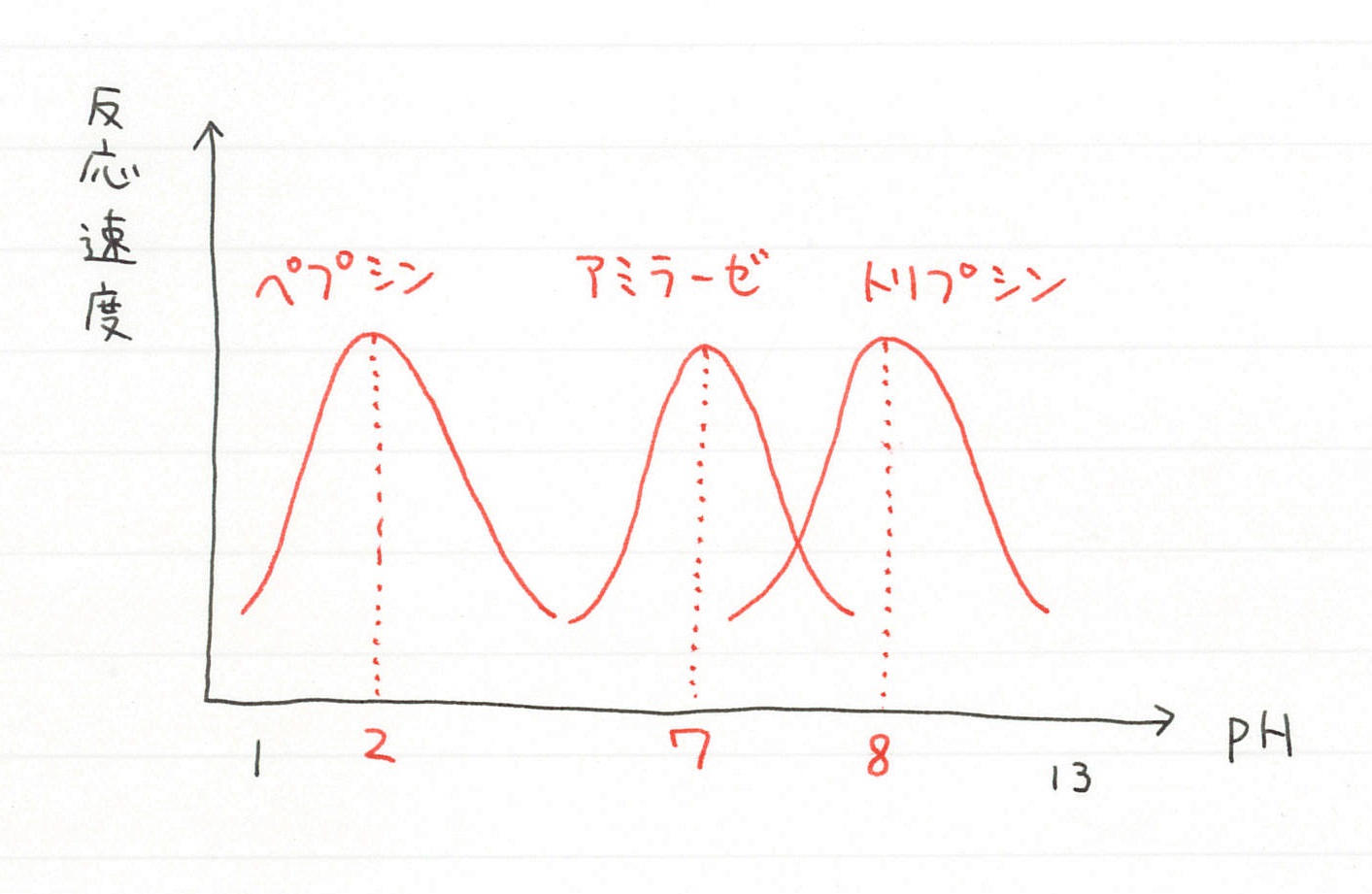
消化酵素の多くは pH が中性付近で最も活性化しますが、胃液のペプシンは酸性下で活性化します。
確かめ問題
アミラーゼはデンプンを何に分解する?
- アミノ酸
- マルトース
- グリセリン
- ペプチド
触媒の活性化エネルギーと酵素基質複合体
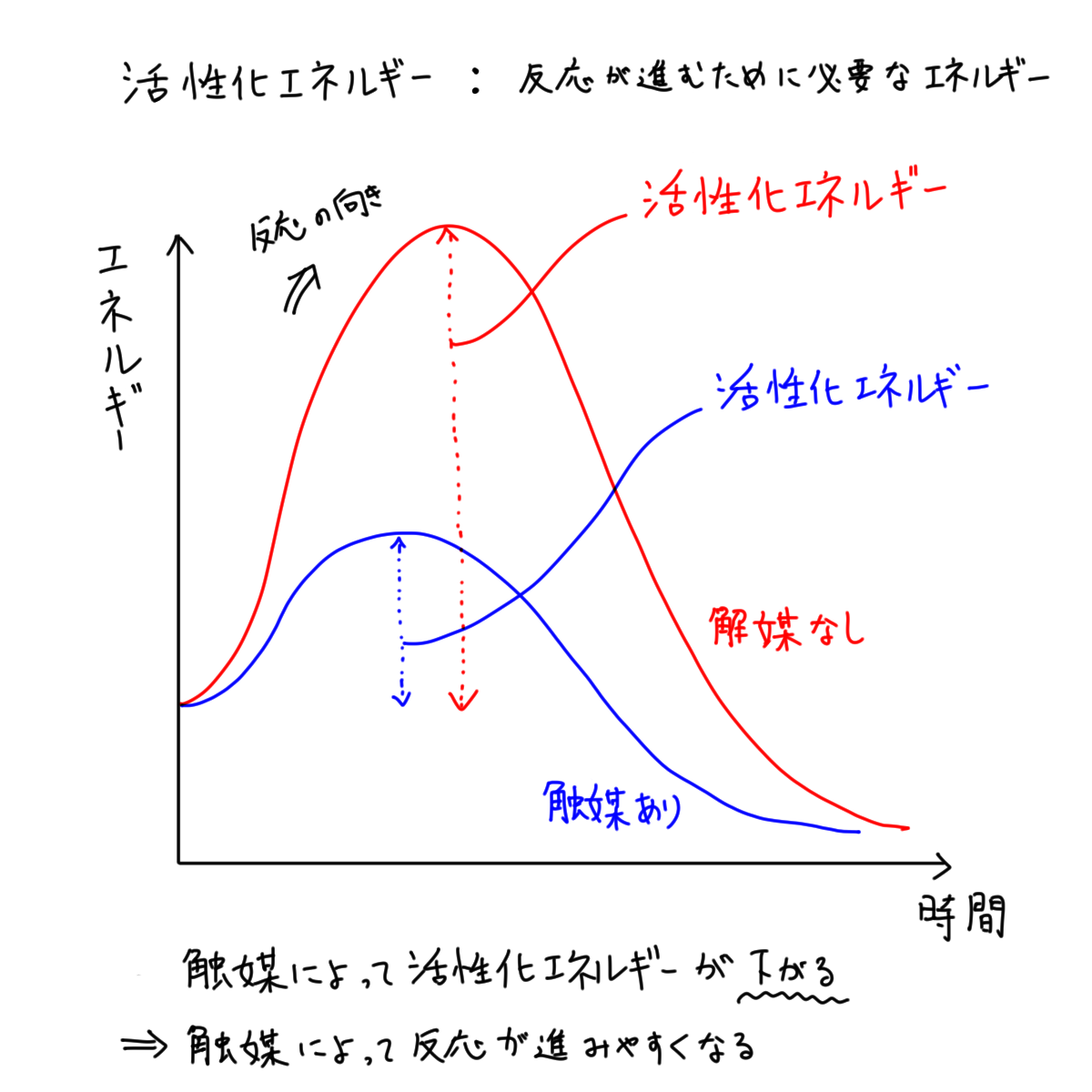
化学反応が進むためには活性化エネルギーと呼ばれるエネルギーが必要で、エネルギー不足(活性化エネルギーに満たないエネルギー)の時は反応は起きない。
活性化エネルギー
触媒はこの活性化エネルギーを下げる役目を果たします。ところで反応に必要なエネルギーはどこからくるのでしょうか?
生体内の反応の場合、必要なエネルギーは周囲(環境)の熱から調達します。周囲の温度が高ければ高いほど化学反応に必要なエネルギー、すなわち活性化エネルギーを調達しやすくなり、反応が促進されるわけです。
実際は、温度があまりに高いと反応に関わるタンパク質が壊れてしまい、「反応がスムーズに進む、タンパク質が壊れないギリギリの温度」が存在します。その温度こそが私たちの体温なのです。
酵素
酵素と基質の反応は上の図のように酵素基質複合体を経て進みます。酵素と基質が結合すると基質が分解されます。
酵素の最適温度と最適pH
酵素は無機の触媒と異なり一種のタンパク質であるため、高温になると形が崩れて働きを失います。タンパク質の本来の働きが失われることを失活といいます。
タンパク質は温度が高すぎても低すぎても失活するため、酵素に応じた最適な温度が存在します。ほとんどの酵素は体温付近の40度を最適温度としています。
また酵素の働きが最も活性化される pH も存在します。これを最適 pH といい、アミラーゼは pH = 7 で最もよく働きます。多くの酵素は pH = 7 前後で活性化されますが、ペプシンは pH = 2 で活性化されます。
高温や高 pH によって失活した酵素は、温度や pH を最適な環境に戻しても働きません(不可逆性)。
基質特異性
前述のとおり、基質は酵素と結合し、酵素基質複合体を経て分解されますが、酵素と基質はちょうど鍵と鍵穴のような関係にあり、基質という鍵穴にすっぽり結合する酵素は限られています。
アミラーゼはデンプンと反応しますが、脂肪とは反応しません。
酵素が特定の基質としか反応しない性質を基質特異性といいます。
酵素と基質は鍵と鍵穴の関係にありますが、酵素の立体構造のすべてが基質と関わっているとは限りません。酵素の一部の立体構造が相手基質にとって「鍵」となっているのです。この基質に関わる一部の立体構造「鍵」を活性部位といいます。活性部位は活性中心とも呼ばれますが、どちらも重要なキーワードです。
補助因子
酵素の中にはそれ自体では働きを示さないものがあります。これらは補助因子と呼ばれる物質と結合し、初めて酵素としての働きを持ちます。
補助因子は補酵素と金属イオンに大別されます。例えばカルシウムイオンはアミラーゼの補助因子です。アミラーゼとカルシウムイオンが結合することでアミラーゼ本来の働きが表れます。しかし多くの酵素は金属イオンでなく補酵素と呼ばれるタンパク質を補助因子としています。
酵素と結合して酵素の働きを活性化させる物質を補助因子という。補助因子はタンパク質の補酵素と金属イオンに分けられる。
補酵素はあくまでも酵素と同様タンパク質です。しかし酵素と違って一般的に分子量が小さく、熱に強い性質を持ちます。代表的な補酵素にNAD+やNADP+があります。
補酵素を必要とする酵素本体をアポ酵素といい、補酵素とアポ酵素が結合したタンパク質をホロ酵素といいます。
このホロ酵素が基質と結合して酵素基質複合体を作りますが、アポ酵素単体あるいは補酵素単体では基質と結合できません。あくまでもアポ酵素と補酵素が結合したホロ酵素が基質特異性を持つのです。
酵素の機能別分類
酵素には加水分解酵素やトランスフェラーゼといった種類があり、多くは「~アーゼ(ase)」というサフィックスがつく。
医学と薬学の研究で酵素の解明が進むと、その多様性を管理するために分類法が必要になりました。そこで国際生化学分子生物学連合の酵素委員会は、酵素をECから始まる番号で命名しました。
| 種類 | 機能 |
|---|---|
| オキシドレダクターゼ | 酸化還元反応の触媒 |
| 加水分解酵素 | 水と反応させて分解する |
| リアーゼ | 分解する |
| リガーゼ | 合成する(ATPを使う) |
| トランスフェラーゼ | ある物質の一部を別の物質に移す |
例えば、リアーゼは物質から二酸化炭素などの物質を脱離させる酵素です。二酸化炭素を脱離させる酵素をデカルボキシラーゼといいます。高校生物ではリアーゼ=デカルボキシラーゼのように習いますが、デカルボキシラーゼはリアーゼの一種です。
問題
基質と酵素を同じ容器に入れた時の反応を観察する。この時、基質の濃度を上げていくと反応速度は一定値まで上昇するが、その後は濃度を上げてもほとんど上昇しない。この二つの現象について理由を述べなさい。
解答
基質濃度が低い時は濃度上昇にともなって単位時間当たりに作られる酵素基質複合体の量が増加するため反応速度が上昇するが、すべての酵素が酵素基質複合体を形成した段階で基質濃度を上げても反応に関わらない基質が生じ、反応速度の上昇が止まってしまうから。