銅(Cu)は原子番号29、4周期11族に属する。
11族は銅に始まり、銀、金と続く。単体の純銅は赤っぽい色で、比較的やわらかい。熱伝導性、電気伝導性に優れる。10円玉の原料。
| 項目 | Cu |
|---|---|
| 原子番号 | 29 |
| 周期 | 4 |
| 族 | 11 |
| 電子殻 | 2, 8, 18, 1 |
| 原子量 | 63.5 |
| 分類 | 遷移元素 |
| 炎色反応 | 青緑 |
| 常温常圧 | 固体(赤銅色) |
銅は2価の陽イオンになり、化合物は酸化銅、硫酸銅、硫化銅などがある。また錯イオンを形成する。炎色反応では青緑色を生じる。
性質
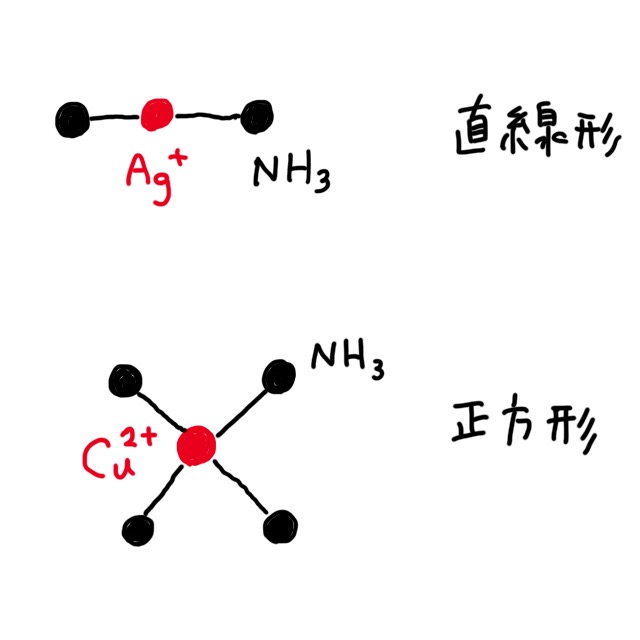
銅は2価の陽イオンになる。銅イオンは青色で、錯イオンを形成するときは正方形をなす。銅に配位結合する配位子はアンモニア。
cion
銅イオンと酸化銅の反応
中学理科では次の反応をあつかう。
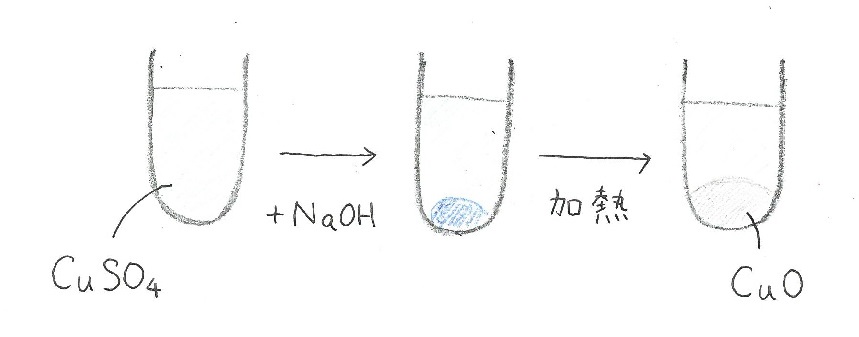
硫酸銅
銅イオン(硫酸銅など)に水酸化ナトリウム水溶液を加えると、Cu(OH)2の青白色沈殿が生じる。
沈殿が生じたこの溶液を加熱すると、CuOの黒色沈殿が生じる。
実は、このCuO沈殿のある溶液に希硫酸を加えると、もとの水色にもどる。これは酸化銅が銅イオンになるため。
水色
Cu2+
+水酸化ナトリウム
青白色沈殿
Cu(OH)2
+加熱
黒色沈殿
CuO
+希硫酸
水色
Cu2+
酸化
希硝酸
3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
濃硝酸
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
熱濃硫酸
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
希硝酸と濃硝酸では発生する気体が異なり、それぞれ一酸化窒素、二酸化窒素が発生する。また熱濃硫酸では二酸化硫黄が発生する。
CuO、Cu2O
どちらも酸化銅だが、CuOは酸化銅(Ⅱ)、Cu2は酸化銅(Ⅰ)である。銅を加熱酸化すると酸化銅(Ⅱ)ができるが、超高温では酸化銅(Ⅰ)ができる。
CuSO4
CuSO4(硫酸銅)は一般的に五水和物として存在する。五水和物状態では青色だが、加熱されて水分子がとれると白くなる。
硫酸銅水溶液は後述する電解精錬に使われる。
CuS
CuS(硫化銅)は、銅をふくむ水溶液に硫化水素を加えると黒色沈殿として出てくる。
Cu(OH)2
銅イオンをふくむ水溶液に水酸化ナトリウム水溶性を加えると、Cu(OH)2(水酸化銅)の青白沈殿ができる。過剰に水酸化ナトリウムを加えてもこの沈殿は消えない。
銅イオンをふくむ水溶液にアンモニア水を加えると、同様にCu(OH)2の青白沈殿ができる。しかし過剰に加え続けるとこの沈殿は消える。これは錯イオンができたため。このとき全体の水溶液の色は濃青色になっている。
Cu2+ (青~水色)
+アンモニア水
Cu(OH)2 (青白沈殿)
+アンモニア水
[Cu(NH3)4]2+ (濃青色)
銅の製法
銅は銅鉱石(CuFeS2)から電解精錬によってとりだす。
銅鉱石を溶鉱炉などを通して硫化銅(Ⅰ)をつくる。この硫化銅を転炉内で酸化し、粗銅を得る。
粗銅を電解精錬によって純銅にする。電解精錬は電気分解そのものであり、硫酸銅水溶液において陽極に粗銅、陰極に純銅をおく。
陽極はプラスの電気が流れる極板であり、電子を放出する極板である。電気分解によって粗銅から銅イオンがはがれて、硫酸銅水溶液に溶けこむ。その銅イオンは陰極について極板から流れてきた電子と結合して銅となる。
このようにして陰極の極板である純銅に粗銅の銅が集まる。
電気分解によって粗銅は分解するが、銅以外の物質は硫酸銅水溶液の底に陽極泥としてたまる。この陽極泥には金などの高価な金属がふくまれていることがある。