硫酸(H2SO4)は硫黄をふくむ強酸性・不揮発性の液体。濃硫酸は希硫酸に比べて酸が弱いが、熱濃硫酸は酸化力が非常に強い。
硫酸の性質
希硫酸と濃硫酸は酸化力に違いがあるものの、どちらも強酸性・不揮発性・粘性をもつ。
揮発性とは液体の蒸発しやすさで、揮発性という言葉自体で蒸発しやすいこと、不揮発性は蒸発しにくいことを意味する。
硫酸と硝酸の大きな違いはこの揮発性にある。硫酸は不揮発性だが、硝酸は揮発性であり、この違いを利用して硝酸塩から硫酸をとりだすことができる。
濃硫酸の性質
濃硫酸は脱水力と吸湿性をもち、乾燥剤として使われる。希硫酸は脱水力をもたない。
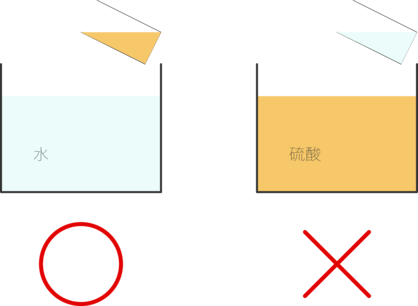
濃硫酸を希釈するときは、大量の水に濃硫酸を入れるようにする。濃硫酸に水を入れることは厳禁である。
濃硫酸に水を入れると、水が濃硫酸の表面につく。濃硫酸は水よりも密度が大きいので、水についた濃硫酸は沈まず、周りの水と反応する。その反応熱で水は沸騰し、周囲に飛び散る。
濃硫酸はどちらの性質をもつか?
- 揮発性
- 不揮発性
硫酸イオンと 2 族元素の反応
硫酸イオンはアルカリ金属などと塩をつくる。2族元素の硫酸塩の可溶性は次のとおり。
| 物質 | 性質 |
|---|---|
| ベリリウム | 溶ける |
| マグネシウム | 溶ける |
| カルシウム | あまり溶けない |
| ストロンチウム | 溶けない |
| バリウム | 溶けない |
硫酸バリウムはX線造影剤として使われる。
硫酸の製法
硫酸は接触法によってつくる。
硫黄を加熱して二酸化硫黄をつくる
S + O2 → SO2
二酸化硫黄を酸化バナジウム(Ⅴ)触媒のもと
酸化して三酸化硫黄をつくる
2SO2 + O2 → 2SO3
三酸化硫黄を濃硫酸に入れて発煙硫酸にした後
発煙硫酸に希硫酸を入れて濃硫酸をつくる
SO3 + H2O → H2SO4
酸化バナジウム(Ⅴ)はV2O5。
硫酸とベンゼン
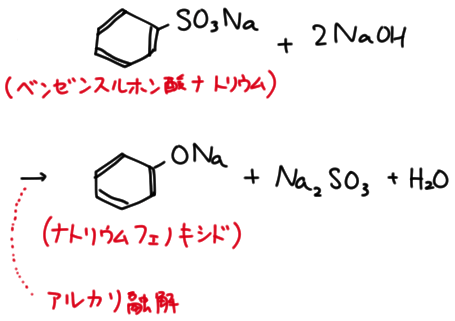
ベンゼンスルホン酸ナトリウムからナトリウムフェノキシド
ベンゼンに硫酸を加えて加熱すると、ベンゼンスルホン酸ができる。
ベンゼンスルホン酸を水酸化ナトリウムで中和したベンゼンスルホン酸ナトリウムは有機化学において中心的であり、フェノール製造の出発点でもある。








