| 性質 | 内容 |
|---|---|
| 原子番号 | 8 |
| 周期表 | 2周期16族 |
| 原子量 | 32.07 |
| 常温状態(※) | 固体(黄色、褐色) |
| 元素区分 | 典型非金属 |
硫黄の単体(同素体)
| 種類 | 性質 |
|---|---|
| 斜方硫黄(S8) | 最も安定した状態。環状構造。黄色の塊状固体。 |
| 単斜硫黄(S8) | 不安定した状態。環状構造。黄色の針状固体。 |
| ゴム状硫黄(Sn、nは任意) | 鎖状構造。褐色のゴム状固体。 |
硫黄の反応
チオ硫酸イオンに酸を加える
S2O32- + 2H+ → SO2 + H2O + S
二酸化硫黄の酸化
2SO2 + O2 → SO3
三酸化硫黄を濃硫酸に吸収させる(※)
SO3 + H2O → H2SO4
銅に濃硫酸を加える
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
亜硫酸水素ナトリウムに希硫酸を加える
NaHSO3 + H2SO4 → NaHSO4 + H2O + SO2
ヨウ素ヨウ化カリウム水溶液に二酸化硫黄を加える
I2 + SO2 + 2H2O → H2SO4 + 2HI
二酸化硫黄水溶液に硫化水素を加える
SO2 + 2H2S → 2H2O + 3S
硫化鉄に希硫酸を加える
FeS + H2SO4 → FeSO4 + H2S
硫黄を含む化合物
硫酸
H2SO4
強酸。濃硫酸は吸湿作用と脱水作用があり、気体の乾燥剤として使われる。濃硫酸を希釈する時は大量の水に濃硫酸を加える。
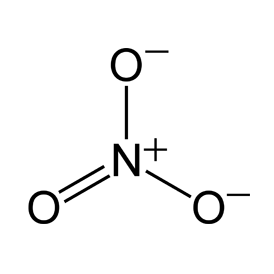
二酸化硫黄
SO2
酸性酸化物の無色刺激臭の気体。酸化剤でもあり還元剤でもある。二酸化硫黄の酸化作用と還元作用は入試によく出る。銅に濃硫酸を加えて二酸化硫黄を得る反応式は非常に重要。高校化学で最も頻出の物質。
三酸化硫黄
SO3
酸性酸化物で無水硫酸とも呼ばれる。濃硫酸に吸収させると発煙硫酸が生じる。二酸化硫黄を酸化バナジウム(V2O5)触媒で酸化して得られる。
硫化水素
H2S
強力な還元剤で、ある種の金属イオンと反応して沈殿物を得る。