物質は細かくできる。例えば角砂糖は砕いて粉末状にできる。岩も風雨にさらされて細かくなり、やがて石になる。石もまた転がったり踏まれたりして細かくなり、やがて砂になる。
このようにあらゆる物質は細かくできる。しかし「それ以上細かくできない物質」がある。ここまできたら分けることができないという物質。これを分子という。
分子はその物質の性質を示す最小単位である。例えば食塩の最小単位である分子は塩化ナトリウムという分子、塩酸の最小単位である分子は塩化水素という分子である。
塩化ナトリウムという分子は基本的にパカッと分けることはできない。分けてしまうと、もはやそれは食塩ではないまったく別の物質になってしまう。

chemical_compound_1
分子はその物質の性質を示す最小単位。基本的にそれ以上分けられず、もし分けてしまうともはやその物質は別の物質になってしまう。
「基本的に」という言葉が示すように、実は分子も無理やり分けられる。塩化ナトリウム分子を無理やり分けると塩素とナトリウムが出てくる。するともはや食塩ではない、非常に危険な物質(塩素もナトリウムも危険)が生まれる。
しかしこの塩素とナトリウムはどんな方法をもってしてもそれ以上分けることはできない。塩素は塩素でしかなく、ナトリウムなナトリウムでしかない。この「真にそれ以上分けられない物質」を原子という。
原子の性質
- それ以上分けられない。
- 化学反応によって生まれたり、消えたり、他の原子になったりしない。
- その物質が気体、液体、固体になっても、それを構成する原子が別の原子になることはない。
- 質量(重さ)が決まっている。化学反応によって質量は変化しない。
- 種類によって大きさが異なる。
- 一つ一つにアルファベットの記号が割り当てられている(H、O、Cなど)。
化学の教科書の表紙の裏についている表を周期表という。周期表にはこれまで発見されたすべての原子がのっている。
周期表は、原子を軽いものから重いものまで順番に並べている。下にいけばいくほど重く、右にいけばいくほど重い。したがって一番左上にある水素が最も軽い原子である。
中2理科で習う原子リスト
- H … 水素
- O … 酸素 (ゼロではない。アルファベットのオー)
- C … 炭素
- N … 窒素
- Na … ナトリウム
- Cl … 塩素
- Fe … 鉄
- Ag … 銀
- Cu … 銅
- Mg … マグネシウム
- Ca … カルシウム
特に水素、酸素、炭素、窒素の四つは非常に重要。
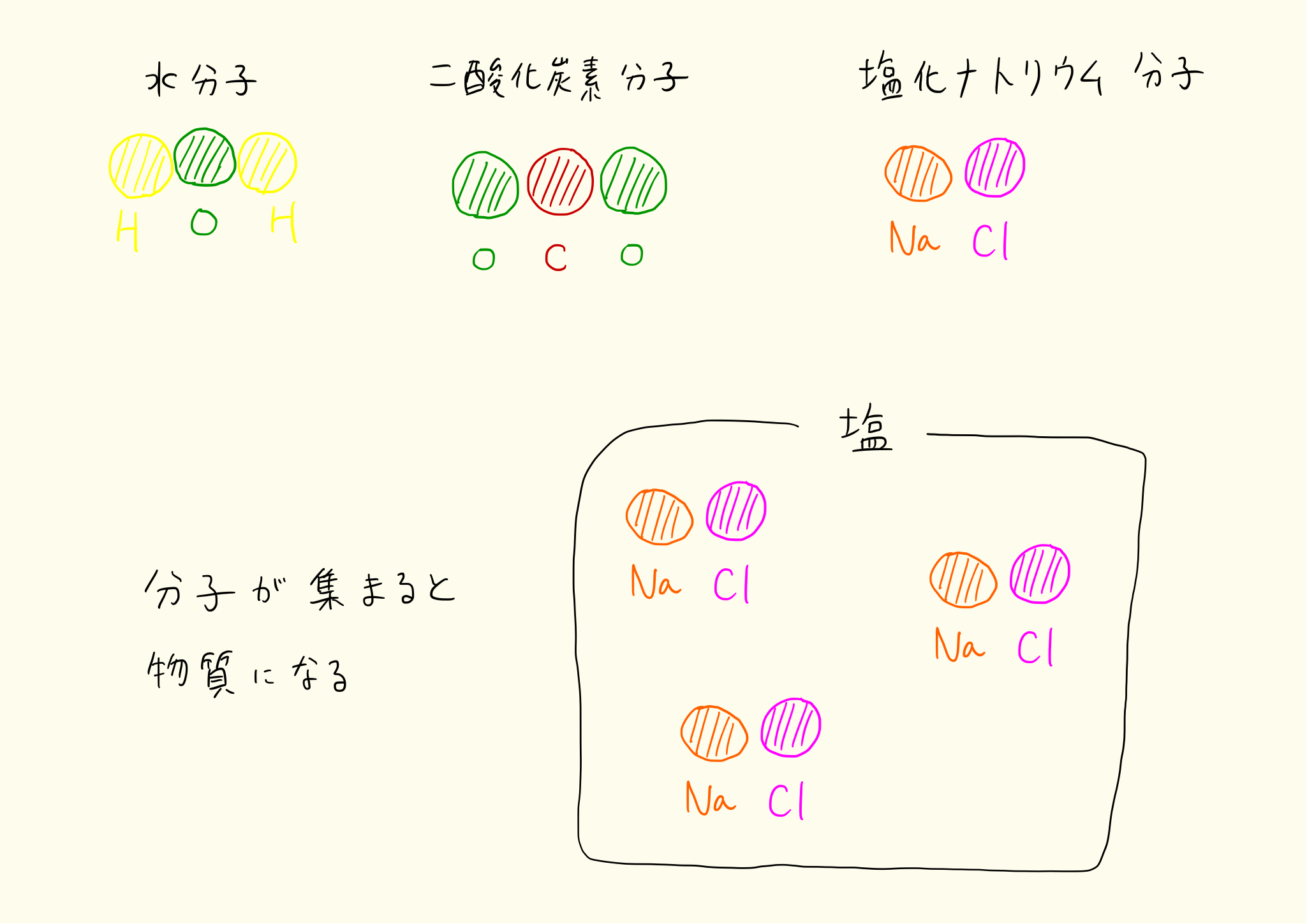
分子
前述のとおり、物質の最小単位を分子という。分子は基本的にそれ以上分けることはできない。それ以上分けるとその物質はまったく別の物質に変わってしまう。
chemical_compound_2
分子の代表的な例
- 水 = 酸素 + 水素
- 二酸化炭素 = 炭素 + 酸素
- 塩化ナトリウム = 塩素 + ナトリウム
塩化ナトリウム分子は、1個の塩素原子と1個のナトリウム原子がくっついた分子。一方、二酸化炭素は1個の炭素原子と2個の酸素原子がくっついた分子。
上の式だと二酸化炭素に含まれる酸素の個数がわからない。分子を構成する原子の個数をわかるようにしたものを化学式という。
化学式の例
- 二酸化炭素 … CO2
- 塩化ナトリウム … NaCl
- アンモニア … NH3
同じ原子が1個のときは数字を書かず、同じ原子が2個以上あるときは数字を右下に書く。例えばアンモニア分子に含まれる水素原子(H)の数は3個で、窒素原子の数は1個。
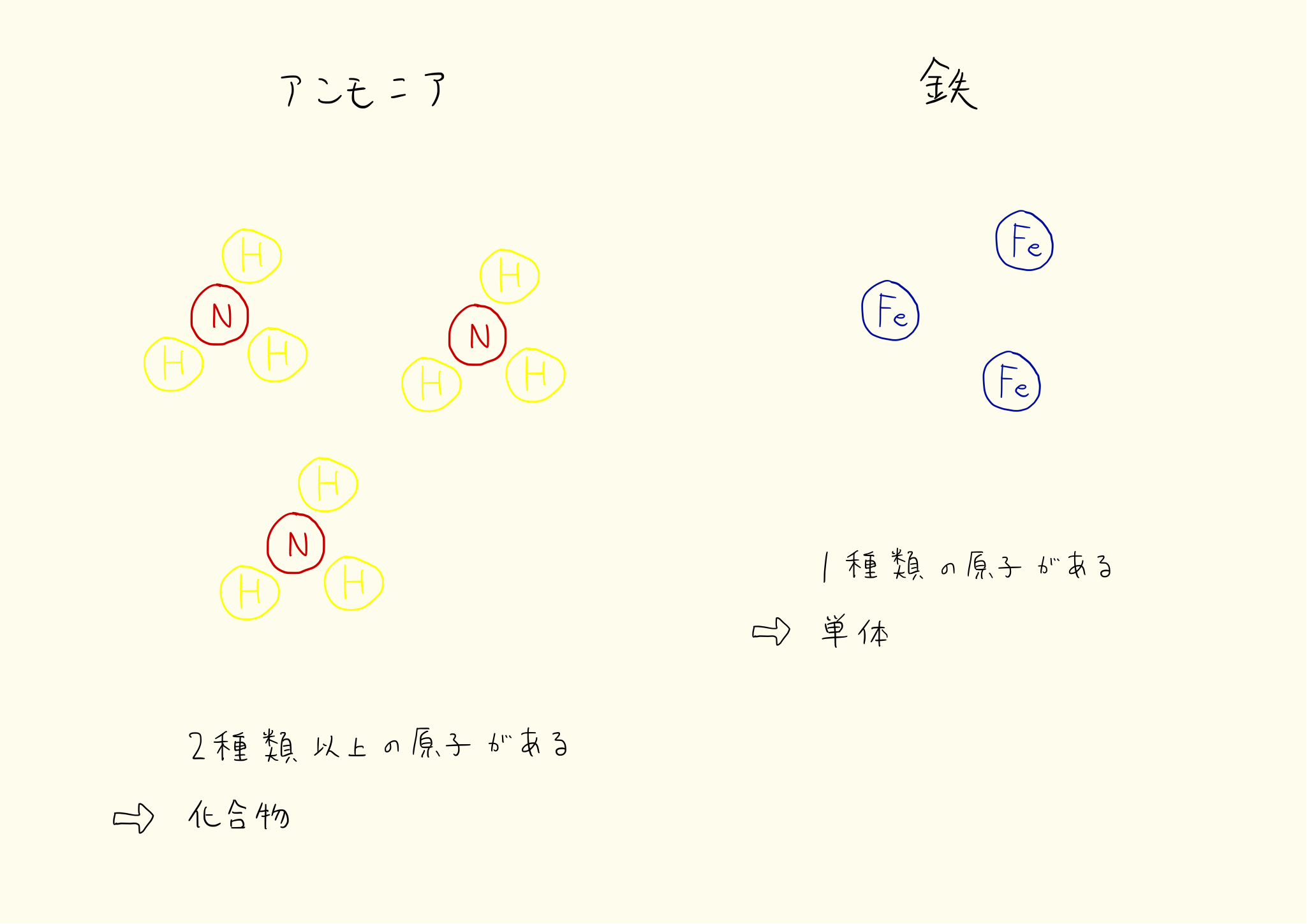
単体と化合物
物質を構成する原子が一種類のものを単体、二種類以上のものを化合物という。例えば鉄はどこまで細かくしても鉄でしかなく、最小単位は鉄原子である。したがって鉄は単体となる。
chemical_compound_3
その物質が単体か化合物かの判断は、分子が一種類の原子でできているか、二種類の原子でできているかの違いでわかる。
単体の例
- H2
- O2
- N2
- C
- Fe
- Ag
化合物の例
- H2O
- CO2
- NH3
- NaCl








