原子は原子核の周りにランダムに配置されるわけではなく、K 殻、L 殻といった電子殻に規則正しく配置される。電子殻は内側から外側に向かって K、L、M、N、O、P 殻とある。
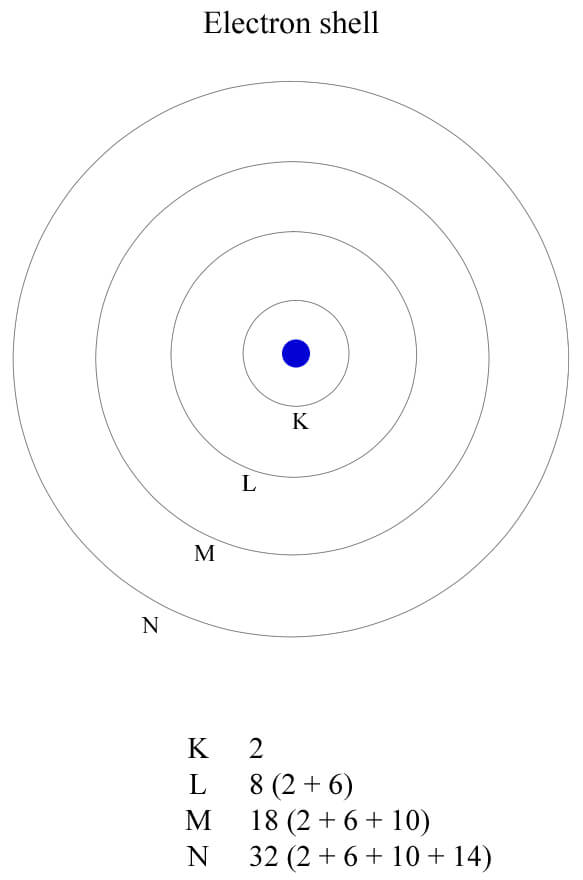
電子殻
例えば、水素原子の電子は一番内側の K 殻に入る。それぞれの電子殻に収容できる電子数は決まっている。
| 電子殻 | 最大電子数 |
|---|---|
| K | 2 |
| L | 8 |
| M | 18 |
| N | 32 |
| O | 50 |
例えば原子番号 2 のヘリウムは 2 個の電子が K 殻にちょうどおさまる。次の原子番号 3 のリチウムは 3 個の電子にうち、まず 2 個の電子が K 殻に入り、残りの 1 個が L 殻に入る。
リチウム
K 殻 2 個
L 殻 1 個
電子軌道
上図では、あたかも惑星の円軌道のように電子殻が描かれているが、実際はそうでない。また電子も、 1 個のボールが円を描くように回っているわけでない。
電子は雲のように考えるとわかりやすい。電子は、ボールというよりは「ふわっとした雲」である。
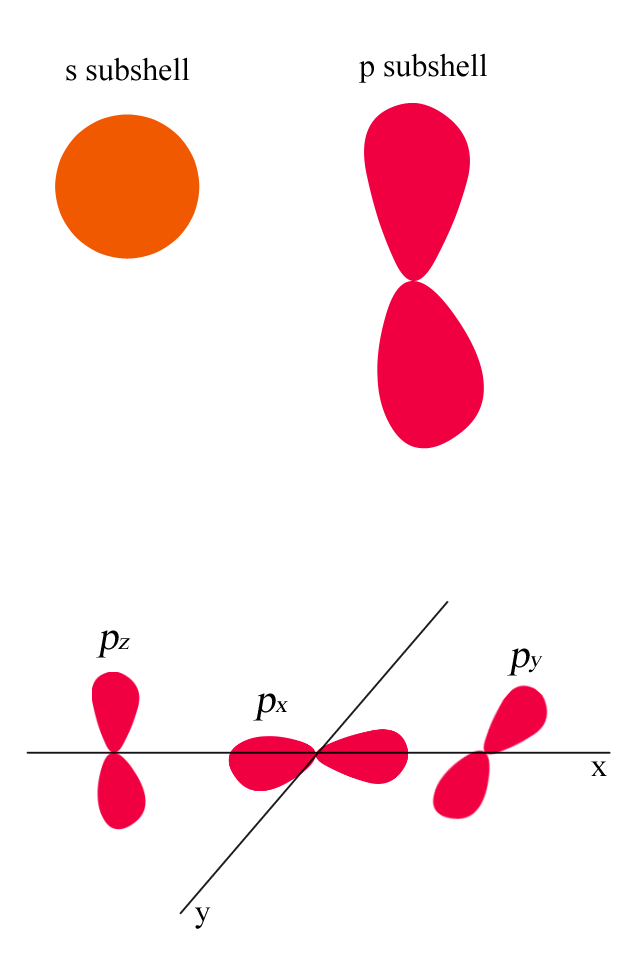
subshell
電子の存在する位置を確率で表すと上図のようになる。この電子の形を電子軌道という。電子軌道はあくまでも存在確率であり、実際に存在している形ではない。
s 軌道 … 球状
p 軌道 … 八の字
図の p 軌道は歪んでいるが、実際は正確な八の字である。例えば、水素原子の電子(1 個しかない電子)は s 軌道であり、球状に広がっている。一方、窒素の最外殻電子(3 個)は p 軌道である。
電子軌道は s, p, d, f, g などがある。
電子殻と電子軌道
s 軌道などの電子軌道は、その電子が存在している電子殻と関係する。例えば K 殻には s 軌道しかなく、p 軌道はない。それぞれの電子殻にある電子軌道は次のとおり。
| 電子殻 | 電子軌道(数) |
|---|---|
| K | s(2) |
| L | s(2) p(6) |
| M | s(2) p(6) d(10) |
| N | s(2) p(6) d(10) f(14) |
M 殻からは d 軌道や f 軌道といった複雑な電子軌道がある。
電子殻と電子軌道の例
フッ素の 9 個の電子はどのように分布しているだろうか。まず収納される電子殻は
K 殻 … 2 個
L 殻 … 7 個
となる。L 殻には 2 個の s 軌道と 6 個の p 軌道がある。フッ素の L 殻にある 7 個の電子は
s 軌道 … 2 個
p 軌道 … 5 個
に分かれる。まとめると
K 殻の s 軌道 … 2 個
L 殻の s 軌道 … 2 個
L 殻の p 軌道 … 5 個
となる。








